干细胞修复视神经损伤,失明者重见光明
视神经损伤
人类的视神经由大量的视网膜神经节细胞的轴突汇聚而成,作为中枢神经系统的一部分,发挥着将视觉信息从视网膜传递到大脑的重要作用。
视神经损伤是许多眼部疾病,包括青光眼高眼压、外伤性病变、肿瘤性病变、代谢障碍、头颈部放射治疗并发症,以及神经退行性病变等导致视功能损害的共同作用环节。视神经损伤的病理改变均为视网膜神经节细胞(RGCs)的不可逆丢失,严重时会造成患者视神经萎缩和视功能丧失。
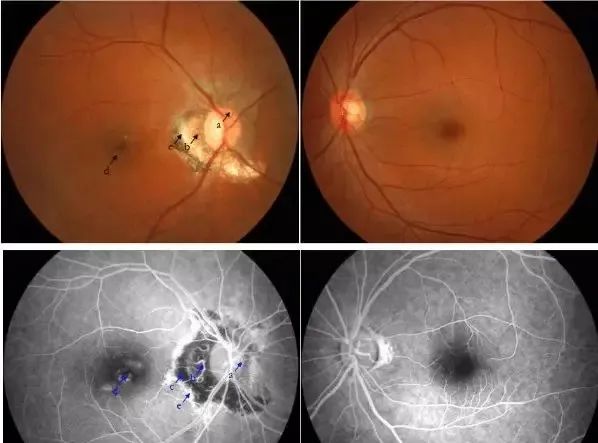
视神经损伤通常分为直接损伤和间接损伤。直接损伤通常由于眼部或头部外伤所致,头部外伤导致的视神经损伤则被称之为外伤性视神经炎病变,病情较为严重,可能会导致视力严重下降,甚至完全失明。间接损伤则是因为其他疾病或状况间接导致的,如开颅手术、颅内高压、脑脓肿等。这类损伤可能导致视力逐渐下降或者视野缺损。
为了治疗视神经损伤,目前临床上主要采用视神经管减压术以及给予神经营养物质等方法,然而视神经和中枢神经系统一样,再生能力极弱,治疗效果有限。

根据世界卫生组织2019年发布的首份《世界视力报告》,目前全球有超过22亿人视力受损或失明,其中有超过10亿人因近视、远视、青光眼和白内障等问题未得到必要的治疗所致。
随着全球视力受损或失明人群的增加,并且许多眼科疾病的治疗效果有限,干细胞因其具备自我更新、 强大增殖能力和多向分化潜能,为视神经损伤的治疗开辟了新的道路。
干细胞用于治疗视神经损伤
近年来随着生物医学的发展,干细胞在视神经损伤修复方面的研究不断深入,带来新希望。
用于视神经损伤治疗的干细胞主要分两类:
间充质干细胞
间充质干细胞(MSCs)是目前研究最成熟、应用最广泛的一类干细胞。它们具有来源广泛易获得、免疫排斥反应较弱、分离培养增殖速度快和易于外源基因表达等优点。
MSCs进入中枢神经系统后,会迁移至全脑并分化为各型神经细胞。其作用机制主要有三种:MSCs向病变组织渗透融合、替代损伤细胞和重建神经环路;MSCs在新环境诱导下表达出神经细胞表型;以及MSCs与宿主神经组织互相作用促进神经营养因子生成。
目前,临床上已经应用MSCs治疗视神经损伤,并且治疗前后相比,患者的视力和闪光型视觉诱发电位均有所改善,这证明了采用MSCs治疗视神经损伤是有效的。
干细胞
干细胞具有分化为神经元、星形胶质细胞和少突胶质细胞的能力,与宿主神经组织融合良好,并能长期存活。干细胞治疗后能够移行整合至视网膜并分化为各型细胞,建立广泛的细胞连接,甚至长出神经纤维伸入视神经起始端。同时,通过对局部微环境调控,分泌神经营养因子及信号分子,启动宿主内源性修复机制,为内源性NSCs提供生存支持并激活其分化为神经细胞。
Koike等学者在研究中将人脐血干细胞(hUCBSCs)移植入小鼠视网膜下腔。经过2周的观察,他们发现部分hUCBSCs已经分化为视网膜神经细胞。这一发现揭示了细胞替代可能是MSCs用于治疗视神经损伤的重要机制。为了验证这一机制,他们更换了移植部位并进行了类似的实验,证实玻璃体腔内移植MSCs可以有效减缓视神经损伤后RGCs的继发性破坏,抑制其凋亡。
2020年12月3日,哈佛大学医学院David Sinclair团队的吕垣澄博士与何志刚及Bruce Ksander等团队合作在《Nature》杂志上发表了一篇题名为《Reprogramming to recover youthful epigenetic information and restore vision》的封面文章。该研究利用基因治疗诱导神经节细胞重编程,恢复年轻的表观遗传信息,从而使得视神经能够在损伤后再生,并逆转青光眼和衰老造成的视力下降。这项突破性的研究成果为治疗视神经损伤提供了新的思路和方法。
眼科专家陶勇医生表示,近视眼未来一定会被干细胞技术治愈,同时希望大家保持希望,迎接新技术到来。这一话题也上了热搜。
科技进步为我们的健康提供了更优质的保障,以往无法得到根治的视神经损伤也逐渐找到了新策略,干细胞正是其中之一。
 中文
中文
 English
English




